Güncel Retina Görüntüleme Cihazları
GÜNCEL RETİNAL GÖRÜNTÜLEME YÖNTEMLERİ
TARİHÇE:
1-OFTALMOSKOP
Hermann von Helmholtz tarafından 1850 yılında direkt oftalmoskobun kullanıma sunulması ile, klinisyenler ilk kez yaşayan kişilerde retinayı görebilme imkanına kavuşmuştur. Direkt oftalmoskobun kullanıma girmesinden 2 yıl sonra ise, Ruete tarafından derinlik hissi ve daha geniş görüş açısı sağlayan indirekt oftalmoskop geliştirilmiştir. Böylelikle klinisyenler periferik retinayı da değerlendirilebilme şansına kavuşmuştur. Bu gelişmeler sayesinde çeşitli oftalmolojik hastalıklar görülebilmiş, tanımlanabilmiş ve takip edilebilmiştir. Bundan dolayı bu döneme ‘Oftalmolojinin Altın Çağı’ denmektedir. Kronolojik sıra ile yapılan keşifler:
- 1852 Ruete İndirek Oftalmoskop
- 1853 Donders Pigmenter Retinopati
Coccius Retina Dekolmanı
- 1855 Von Graefe Glokomda Diskte Çukurlaşma
Liebreich Santral Retinal Ven Oklüzyonu
Jaeger Diabetik Retinopati
- 1856 Heymann Hipertansif Retinopati
- 1858 Jacobsen Sifilitik Retinit
- 1859/1860 Von Graefe Santral Retinal Ven Embolisi
2- FUNDUS KAMERA
İlk stereoptik fundus fotoğrafı 1886 yılında Jackson & Weber tarafından kaydedilmiştir. Sadece büyük detaylar incelebiliyor olsa da bu cihaz retinal bulguların görüntülenmesinde devrim niteliği taşımaktaydı.
3- FUNDUS FLORESEİN ANJİOGRAFİ (FFA)
İnsan gözünde fundus floresein tekniği ilk kez Novotny ve Alvis adında iki tıp öğrencisi tarafından 1961 yılında uygulanmıştır. Daha sonra oküler dolaşım üzerine çeşitli çalışmalar yapılmış ve vasküler hastalıkların tanımında fundus floresein anjiografi altın standart olarak kabul edilmiştir.
4- İNDOCYANİNE GREEN ANJİOGRAFİ (ICG)
1990’larda yüksek rezolüsyonlu dijital görüntüleme sistemlerinin geliştirilmesi ile ICG için gerekli olan infrared dalga boyu algılanabilmiş ve böylelikle ICG boyası oftalmolojide kullanılmaya başlanmıştır. ICG kullanılarak koroid dolaşımı ve derindeki vasküler yapılar hakkında daha kapsamlı bilgiler elde edilebilmektedir.
5- SCANNİNG LAZER OFTALMOSKOP (SLO)
1980’lerde Webb, Pomerantzeff ve Hughes tarafından geliştirilen bu görüntüleme tekniği ile retina yüzeyi ince bir lazer demeti ile taranmakta ve geri dönen ışık dedektör tarafından algılanmaktadır. Bu yöntem ile çeşitli avantajlar oftalmologların hizmetine sunulmuştur:
- Pupil dilatasyonu gerekli değildir.
- Parlak flaşlar kullanılmadığı için hasta konforu daha iyidir.
- Retinal yüzeyden kaynaklanan artefaktlar daha azdır.
- Çözünürlük konvansiyonel fundus kameralarına göre daha iyidir.
- İnfrared dalgaboyu sayesinde kataraktlı, korneal opasiteli ve kanamalı gözlerde normal fundus fotoğraflarına göre daha iyi görüntüler alınması mümkün olmaktadır.
6- OPTİK KOHERENS TOMOGRAFİ (OCT)
Huang, Hee, Fujimoto ve Puliafito tarafından 1991 yılında geliştirilen bu teknoloji ile, in vivo olarak histolojik kesitler almak mümkün olmuştur. USG analoğu olan bu cihaz, dokudan yansıyan ışığın gecikme zamanını ölçme esasına dayanır. OCT, maküler hastalıkların değerlendirilmesinde yeni bir devrin başlangıcı olmuştur.
GÜNCEL UYGULAMALAR:
1- HEİDELBERG RETİNA ANJİOGRAFİ (HRA)
Günümüzde geliştirilen yüksek hızlı anjiolardan biridir. Konfokal SLO prensibi ile çalışan HRA, hem ICG hem de FFA görüntülerini, istenilirse aynı anda ve aynı ekranda, istenilirse de ayrı ayrı olarak saniyede 16 karelik bir süratle çekebilmektedir. Özellikleri şöyledir:
1- Düşük ışık yoğunluğu ile maksimum hasta konforu: Sıradan flaş ışığı yerine laser ışınlarının kullanılması sayesinde, normal fotografik sistemlerin ihtiyaç duyduğu ışık yoğunluğunun sadece %1’i bile en net görüntülerin alınması için yeterlidir. Pupilayı dilate etmeye gerek yoktur. Bu nedenle pupiller dilatasyon sorunu yaşayan ve retina kliniklerinin en büyük hasta populasyonlarından birini oluşturan diabetik hastalarda kullanışlı bir alettir.
2- Non-invazif uygulamalarda kolaylık: HRA ile herhangi bir enjeksiyon uygulaması yapılmadan, infra-red(IR), red-free ve otofloresans çekimleri rahatlıkla yapılabilmektedir. Hatta IR çekimlerde, laser kaynağının 820 nm’lik dalgaboyu sayesinde kataraktlı gözde bile fundusu görmek, epi-retinal membranı incelemek mümkün olmaktadır. Bu yöntemle, aynı zamanda koroidal nevüslerin ve RPE hastalıklarının takibi de yapılabilmektedir. IR ışığı hastalarca zor seçilebilmekte ve bu nedenle çocuklar gibi ışığa karşı çok sensitif olan hasta gruplarında da irrite edici olmayan bir yöntem olarak kullanılabilmektedir. Red-free çekimlerle retina sinir lifi tabakası hakkında bilgi edinmek mümkün olmaktadır. Otofloresans ise HRA’nın sağladığı bir başka yenilik olup 488 nm dalga boyunda işlem yapmaktadır. Normal FFA ayarlarında floresein enjeksiyonu yapılmadan çekimler alınarak maküler hol, psödovitelliform lezyonlar, santral seröz koryoretinopati(SSKR) ve Best gibi hastalıklar konusunda yararlı bilgiler vermektedir.1-2 Otofloresans ile RPE hücrelerinde biriken lipofuscin granüllerinin belirlenmesi esastır. Otofloresans miktarı lipofuscin birikimi ve temizlenmesi arasındaki dengenin bir göstergesidir. Yüksek seviyeler RPE hücrelerinde fonksiyon bozukluğuna ya da Stargart’da olduğu gibi hücrelere yüklenen aşırı metabolik yüke bağlıdır.3
3- Yüksek Hızlı Dinamik Anjiografi ve Simultane Görüntü Alma: HRA’nın en önemli özelliklerinden biri ise, tüm çekimleri saniyenin küçük fraksiyonlarında tıpkı bir film şeridi gibi hafızasında kaydetmesidir. Mevcut diğer sistemler, flaş ile çekim yaptığı için anjio çekim süratleri, flaş sürati ile sınırlıdır ve genelde 1 kare/saniye’dir. HRA’da ise, FFA ve ICG çekimleri ayrı ayrı yapıldığında saniyede 16 kare, ikisi birlikte eş zamanlı olarak yapıldığında ise saniyede 9 + 9 kare çekim almak ve iki resmi bir arada bir film şeridi gibi izlemek mümkün olmaktadır. Erken evrelerin rahatlıkla incelenebilmesi, ICG’de besleyici damarlar, RAP lezyonları veya retinakoroidal anastamozlar gibi bulguların daha rahat izlenebilmesine olanak vermektedir.4
4- Stereo Görüntüleme, Geniş Açı Çekim ve 3-D Tarama: HRA ile stereo veya istenilirse 3 boyutlu görüntü elde etmek mümkündür. 3 boyutlu inceleme özellikle malign melanom gibi kitlelerin değerlendirilmesinde yararlı olmaktadır. Kompozit mod kullanılarak 120°’ye veya özel Staurenghi Lensi ile 150°’ye kadar geniş açı çekim yapmak mümkündür.
2- NİDEK F-10 DİJİTAL OFTALMOSKOP
Heidelberg grubunun çıkardığı HRA cihazına benzer özellikler taşıyan F-10 dijial oftalmoskop, Nidek firması tarafından son dönemlerde piyasaya çıkarılmıştır. SLO prensibi ile çalışan cihazda HRA’ya benzer olarak yüksek hızda ayrı ayrı veya eş zamanlı FFA ve ICG çekimleri almak mümkün olabilmektedir. Yine enjeksiyona gerek duyulmadan IR, red-free ve otofloresans görüntüleri elde edilebilmektedir. 60° açı adaptörü ile geniş açılı çekimler yapılabilmektedir. Yine video kayıtları ile geriye dönük incelemelerde büyük kolaylıklar sağlanmaktadır.
F-10’da HRA’da olmayan bir özellik olarak, Retro-Mod, kullanıcıların hizmetine sunulmuştur. Bu teknik, herhangi bir enjeksiyon yapılmaksızın fundusu aydınlatmak ve skleradan yansıyan ışığı toplamak suretiyle dejenere hücrelerin görülmesine olanak sağlamaktadır.
3- OCT
16 yıl önce David Huang ve arkadaşları, James Fujimoto labratuarında optik koherans tomografi cihazını geliştirmiştir.5 Ticari olarak üretilen ilk OCT cihazı 1995’te OCT-1 olarak piyasaya sürülmüş, daha sonra 2001 yılında OCT-2 olarak geliştirilmiştir. 2002 yılında OCT-3 kullanıma sunulmuş ve 10 μm’den daha düşük rezolusyonlarda arka segmentin görüntülenmesi sağlanmıştır. OCT retina hastalıklarının değrerlendirilmesinde son dönemlerde artan öneme sahip bir görüntüleme yöntemidir. 6-7
OCT, dokudan geri yansıyan ışığı ölçme esasına dayanır. USG analoğudur. Dokuya gönderilen ışık demeti (800-1400 nm dalga boylu) dokudan yansımaya uğrar ve OCT sistemi yansıyan ışığı toplar ve gecikme zamanını belirler. Daha derin dokulardan yansıyan ışık, yüzeyel dokulardan gelenlere göre daha fazla gecikme gösterir ve bu prensip ile ultrasonografideki A-scan benzeri aksiyel bilgiler elde edilir. Birçok A-scan taramanın toplamı ile ise B-scan görüntü elde edilebilir.
Son dönemlere kadar, genel olarak time-domain modeller kullanılmakta idi. Bu modelin en önemli kısıtlayıcı faktörü, görüntü alma süresinin uzun olmasıdır( 0.5-1.0 B-scans/sn veya 400 A-scan/sn). Hızın yavaş olmasından dolayı retinal haritalar oluşturulurken harekete bağlı artefaktlar ile karşılaşılmaktadır. Fourier-domain veya Spectral-domain OCT(SD-OCT), son dönemlerde geliştirilen alternatif bir görüntüleme yöntemidir.8-9 Bu cihazın en önemli iki avantajı, görüntü alım zamanındaki azalma ve aksiyel çözünürlükte 2-3 µm’yi bulan ultra yüksek görüntü çözünürlüğüdür. SD-OCT, 20,000 A-scan /sn ile 50 kat daha hızlı ölçümler elde edebilmektedir. Bu özellikler neticesinde, daha az artefakta sahip, histolojik detayları verebilecek kadar yüksek çözünürlükte görüntüler elde edilebilmektedir.10-12 Örneğin klasik OCT cihazlarında, senil makula dejenerasyonunda erken damar oluşumları, kistoid makula ödemi veya subretinal sıvı brikimi gibi indirekt parametreler saptanarak takip edilmekte idi. SD-OCT’nin yüksek çözünürlüğü sayesinde koroid-RPE kompleksi hattında detaylı veriler elde edebilmekte ve daha erken dönemde tanı ve tedavi şansı yakalamaktayız. Hızlı ölçüm yapabilmenin sağladığı bir başka ayrıcalık da, kısa sürede 3 boyutlu görüntü oluşturmaya yetecek kadar verinin elde edilebilmesidir.
SD-OCT’nin avantajlarını özetleyecek olursak :
1- Daha yoğun örnekleme imkanı
- a) Küçük lezyonları yakalama
- b) Büyük lezyonlarda daha iyi görüntü
2- Retinada daha geniş alan tarama
- a) Aynı yerden daha çok imaj elde edilir
- b) 3 boyutlu görüntü elde edilir.
3- Hasta hareketine bağlı artefaklarda azalma
- a) Kritik lezyonlarda gelişmiş görüntü kalitesi
- b) Nistagmuslu gözlerde görüntü alma imkanı
- c) Çocuklarda kolay kullanım
Şu an piyasada çeşitli SD-OCT modelleri mevcuttur.
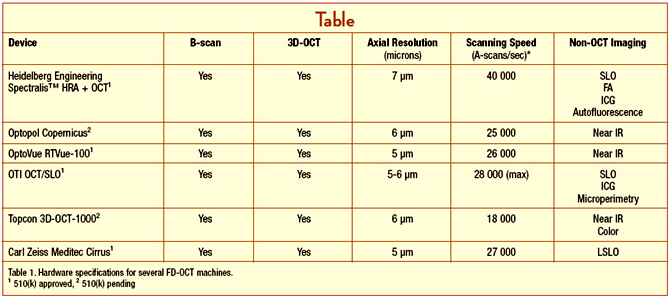
Bu modellere tek tek ve detaylı bir şekilde bakacak olursak:
3-a) The RTVue-100 (Optovue)
FDA onaylı ilk SD-OCT olma özelliğine sahiptir. Klasik SD-OCT’nin özelliklerine sahip, saniyede 26,000 A mod tarama yapabilen ve aksiyel çözünürlüğü 5 μ olan, Optovue firmasının ürettiği yeni nesil bir OCT cihazıdır.
3-b) The 3D OCT-1000 (Topcon)
3D-OCT-1000 isimli Topcon firmasının çıkarmış olduğu bu modelin en büyük ayrıcalığı, fourier domain bir OCT ile nonmidriatik bir retinal kameranın birlikte kullanılmış olmasıyla doktora çok yönlü bir retinal inceleme olanağı sunmasıdır. Retinal görüntü üzerinde istenilen bir nokta işaretlenmek suretiyle o noktanın değerlendirilmesi yapılabilmekte ve tekrarlayan muayenelerde belirgin retinal noktalar kullanılarak aynı bölgenin istikrarlı şekilde takibi sağlanabilmektedir. 3D-OCT, görüntüleme yönünden başka avantajlar da sunmaktadır. Örneğin, makula görüntülenmesi yapıldıktan sonra, doktor muayenesi esnasında ekstrafoveal bir patoloji izlerse geriye dönüp fundus resminde bu alan işaretlenerek değerlendirme yapmak mümkündür. Ayrıca 3D-OCT-1000’deki yazılımlar ile hastanın çekilen FFA veya ICG görüntülerinin, OCT ekranına eklenmesi mümkün olmaktadır. Aksiyel çözünürlük 6 μm olup, tarama hızı 20,000 A-scan/sn’dir.
3-c) The Cirrus HD-OCT (Carl Zeiss Meditec):
Aksiyel çözünürlük 5 μm olup tarama hızı 27,000 A-scan/sn’dir. Cirrus SD-OCT’nin diğer SD-OCT’lerden en önemli farklılığı, retinal katmanların ayrı ayrı yüksek çözünürlük(HD) haritalarını sunabilmesidir. Örneğin HD ILM katman haritası ile vitreoretinal traksiyonlar, HD RPE katman haritası ile PED, drusen gibi patolojilerle ilgili detaylı bilgiler elde edilebilmektedir. Ayrıca HD retinal kalınlık haritası ile maküler ödem değerlendirilebilmektedir.
3-d) The Spectralis HRA+OCT (Heidelberg):
Spectralis HRA+OCT’nin diğerlerinden en önemli farkı, spektral boyutta OCT yapabilen ve aynı anda simültane olarak floresein ve ICG anjiografi görüntülerini video olarak çekebilen, anjio görüntüsü ile OCT görüntüsünü birleştirerek hekime detaylı bir değerlendirme fırsatı yaratan bir cihaz olmasıdır. Aksiyel çözünürlük 7 μ olup tarama hızı 40,000 A-scan/sn (time-domain OCT’ye göre 100 kat hızlı) dir. Şu an piyasada olan SD-OCT’ler içerisinde en hızlı olanıdır.
HRA komponentinden dolayı FFA,ICG, otofloresans, red-free ve infrared görüntüleri elde etme ve bunları OCT ile eş zamanlı görüntüleme şansı sunmaktadır.
Sıradan flaş ışığı yerine laser ışınlarının kullanılması sayesinde, normal fotografik sistemlerin ihtiyaç duyduğu ışık yoğunluğunun sadece %1’i bile en net görüntülerin alınması için yeterlidir. Pupil dilatasyonu gerekli değildir.
Bu kombinasyonun parçaları, Spectralis ailesi içinde OCT( SD-OCT+IR) ve HRA(IR, otofloresans, FFA, ICG, red-free) olarak ayrı ayrı da bulunabilmektedir.
3-e) The SOCT Copernicus (Optopol):
Piyasaya ilk çıkan SD-OCT’dir. Standart bir SD-OCT’nin özelliklerine sahip olup aksiyel çözünürlüğü 6 μm’dir. Tarama hızı ise 25,000 A-scan/sn’dir.
3-f) The SOCT Copernicus HR (Optopol):
Optopol firmasının 3 μ ile en yüksek çözünürlük, 55000A scan/sn ile en yüksek hız ve bunun doğrultusunda en güvenilir tanı iddiasıyla yakında piyasaya çıkaracağı SD-OCT modelidir. Bu modelde diğer OCT’lerden farklı olarak, retinal damarlardaki akım hızının in vivo olarak ölçülmesine olanak sağlayacak doppler analizinin ve hız dağılım haritalarının da bulunacağı firma tarafından belirtilmektedir.
3-g) The Spectral OCT/SLO (OTI):
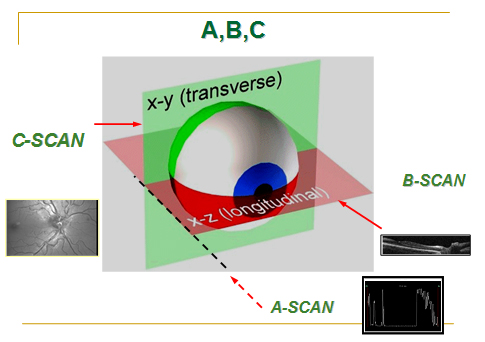
Spectral OCT/SLO, Nidek firması tarafından geliştirilen ve OCT ile SLO sistemlerinin birarada kullanıldığı bir cihazdır. Her iki sistem de aynı lazer kaynağını kullandığı için iki sistemden eşzamanlı görüntü alabilma şansı mevcuttur. OTI tarafından geliştirilen sistemin temelinde, 2 tarama modunun birlikte kullanılması yatmaktadır. B-mod(OCT) ile retinanın aksiyel imajları elde edilirken, C-mod(SLO) ile koronal kesitler elde edilmekte ve hem retina yüzeyi hem de derin katmanlarla ilgili bilgiler eş zamanlı ortaya konmaktadır. Bu özellik sayesinde, OCT taraması yapılırken lokalizasyon konusunda herhangi bir sıkıntı yaşanmamaktadır.
Çoklu C-mod taramalar alınarak 3 boyutlu tomografi ve topografi haritaları elde edilebilmektedir.
Bu sistemde diğerlerinden farklı olarak, makula hastaları için özel olarak geliştirilen bir görme alanı testi olan mikroperimetri özelliği de bulunmaktadır.
4-ULTRASON (USG):
USG’nin ilk kez gözde uygulanması 1950’li yıllarda gerçekleşmiştir. Mundt ve Hughes 1956’da A scan13, Baum ise 1958’de B-scan taramayı ortaya koymuştur14. 1990’ların başlarında 35-50 MHz ile çalışan USG sistemleri ortaya konmuş ve ön segment görüntülenmesinde kullanılmaya başlanmıştır. Bu uygulamanın ilk ticari şekli Zeiss-Humphrey tarafından geliştirilen Ultrasound Biomicroscopi(UBM) dir. Ancak aksiyel rezolüsyonun frekans ile ters orantılı olduğu gerçeği göz önüne alındığında, bu kadar yüksek frekanslardaki aletlerle arka segmentin görüntülenmesinin zor olduğu açıktır. Ancak 10 MHz’lik probların da arka segment görüntülemesinde bazı durumlar için, çözünürlük olarak yetersiz kaldığı son yıllarda klinisyenler tarafından gözlemlenmektedir. Bu nedenle, son dönemlerde arka segmentin yüksek rezolüsyonda görüntülenmesini sağlamak amacıyla 20-MHz’de çalışan problar geliştirilmiştir.15-16
10 MHz ve 20 MHz’lik probların karşılaştırıldığı çalışmalarda, arka vitre dekolmanı, vitreus hemorajisi gibi zayıf eko veren yapılarda 10 MHz problarla elde edilen görüntüler daha netken, koroid, retina, sklera, optik sinir kılıfı ve ekstraoküler kaslar gibi yüksek reflektiviteye sahip lezyonların incelenmesinde 20 MHz’lik problar daha başarılı bulunmuştur.17 USG ölçümleri, genellikle dokudan kaynaklanan atenüasyonların en aza indirilebilmesi için göz açıkken sklera yüzeyinden ve lensten kaçınılarak yapılmaktadır. Bu atenüasyon miktarları 20 MHz problar ile daha fazla olduğundan, travma hastalarında, kooperasyonu zayıf olan hastalarda veya enfeksiyon nedeniyle göz yüzeyinden ölçüm alınamayacak kişilerde 10 MHz problar tercih edilmelidir. Yine intravitreal silikonun yarattığı yüksek atenüasyon nedeniyle silikonlu gözlerde 20 MHz kullanımı neredeyse imkansızdır.17 Genel anlamda ilk muayene ve arka vitre dekolmanı, vitreus hemorajisi gibi vitreoretinal taramalar için 10 MHz’lik problar önerilirken, oküler duvar ve lezyonlarının (koroidal melanom, koroidal nevüs, posterior sklerit) 20 MHz ile incelenmesi daha uygun olacaktır. Sonuç olarak, değişik frekanslarda prob alternatifleri sunan ultrasonların geliştirilmesi yönünde çalışmalar arttırılmalıdır.
Piyasada 20 MHz prob seçeneği sunan firmalar arasında Quantel (CINESCAN, AVISO( 50 MHz UBM PROB) ) ve Tomey (UD-1000(40 MHz UBM prob), UD-6000(40 MHz UBM prob) ) sayılabilir. OTI firmasının piyasaya sürdüğü OTI-Scan 3D modelinde ise, diğer ultrasonlardan farklı olarak video kaydı ve 3 boyutlu görüntü alabilme özelliği bulunmaktadır. 3 boyut özelliği ile kitlelerin takibinde büyük kolaylık sağlanmaktadır.
5- MİKROPERİMETRİ(MP)
Görme fonksiyonunun değerlendirilmesi, oftalmolojik hastalıkların progresyonu veya takibi açısından son derece önemlidir. Genellikle bu amaçla görme keskinliği yaygın olarak kullanılsa da, görme keskinliği günlük aktivitelerdeki değişiklikleri veya görme fonksiyonunu kantitatif olarak değerlendirememektedir. Fundus fotoğraflarındaki morfolojik değişiklikler de, görme fonksiyonu ve retina fonksiyonunun değerlendirilmesinde yetersiz kalmaktadır. Perimetri ise görme fonksiyonunu değerlendirmede faydalı bir yöntem olmakla birlikte, standart Humphrey perimetresi ancak santral görmenin etkilenmediği hastalarında tam olarak güvenilir olabilmektedir. Retina hastalarında ise, santral görme genellikle ilk etaplarda etkilenmekte ve bu hastalar fiksasyon yapamadıklarından gözlerde arama refleksi ortaya çıkmakta, bunun neticesinde de perimetre sonuçlarının güvenilirliği azalmaktadır. Ayrıca düşük görme düzeyine sahip hastalarda standart görme alanı, küçük skotomları( ‹ 5°) tesbit edememektedir.
Mikroperimetri teknolojisi, fundus tracking mikroperimetri ile fundus fotoğrafını tek bir alette birleştirmektedir. Yani cihaz, doğrudan retina üzerinde seçilmiş spesifik lokasyonlarda; bilgisayarlı perimetre yöntemi ile retinanın fonksiyonel görme hassasiyetini nicelik olarak tespit etmekte ve bunu dijital renkli fundus fotografı üzerine empose ederek retinanın fonksiyonel (perimetre) ve morfolojik (retinograf) incelenmesinin birarada yapılabilmesine olanak sağlamaktadır. MP, retina üzerinde kullanıcı tarafından belirlenmiş bölgenin ışık ile uyarılıp hastadan alınan cevap ile o noktanın dB cinsinden görme hassasiyetini verebilmektedir. Başlangıç olarak bir infrared fotoğraf alınmakta ve daha sonra operatör tarafından belirli bir nokta (genellikle damar bifürkasyonları) işaretlenmektedir. Tüm tarama boyunca bu nokta esas alınmakta ve hasta fiksasyonunu kaybetse bile tracking sistemi sayesinde çekime devam edilebilmektedir. Eğer sistem standart noktayı kaybederse, çekime ara vermekte ve ancak tekrar bu noktayı yakaladığı zaman çekime kaldığı yerden devam etmektedir. İşlem bittiği zaman, bir renkli fundus fotoğrafı alınmakta ve görme alanı bu fotoğraf üstüne yerleştirilerek patoloji ve skotom arasındaki bağlantı izlenmektedir. Excimer lazerdekine benzer eye-tracking özelliği sayesinde tekrarlayan muayenelerde aynı noktanın rahatlıkla takibi sağlanabilmektedir. 1 dakikadan daha kısa süren ayrı bir fiksasyon testi ile de hasta fiksasyonunun yeri ve niceliği belirlenebilmektedir.
MP, maküler hastalığı olan hastaların tanısında, tedavi planlanmasında (örneğin cerrahi öncesinde fiksasyon noktası belirlenebilmekte ve özellikle bu nokta cerrahi esnasında korunabilmektedir) ve takibinde kullanışlı bir yöntemdir. Aynı zamanda maküler problemi olan hastaların preop ve postop değerlendirilmesi ile tedavi etkinliği hakkında yararlı bilgiler verebilmektedir. Skotomun yeri ve büyüklüğünün belirlenmesi, aynı zamanda görme rehabilitasyonu açısından da yararlı olacaktır.
Biofeedback özelliği kullanılarak görme rehabilitasyonu için egzersizler yapılabilmektedir. Bu özellik sayesinde fiksasyonun doğru retinal lokalizasyona alınabilmesi için hasta eğitimleri yapılabilmektedir.18
Yapılan çalışmalarda MP sonuçları ile OCT ve ERG sonuçlarının uyumlu olduğu gözlenmiştir. 19
- RETCAM (CLARİTY MEDİCAL)
Günümüzde, retinal patoloji yönünden araştırılan, ancak rutin indirekt oftalmoskopi muayenesinde kooperasyon gösteremeyen çocuklar için, sedasyon ya da genel anestezi altında muayene yöntemleri uygulanmaktadır. Ancak bu uygulamalar hem zaman ve hem de para yönünden israflara yol açmakta ve çocuklar anestezinin ciddi etkilerine de maruz bırakılmaktadır. Tüm bu nedenler doğrultusunda prematür retinopatisinin20-21, retinoblastomun takibi ve shaken baby şüpheli olgularda retinal kanamaların izlenebilmesi ve dökümante edilebilmesi için RetCam isimli dijital renkli fundus kamerası geliştirilmiştir. Cihazda bulunan FFA aparatı ile FFA görüntüleri, neonatal glokom olgularında optik sinir görüntüsü ile ön segment görüntüleri de alınabilmektedir. Cihaz ile hem renkli fundus fotoğrafları hem de video çekimleri elde etmek mümkündür.
Muayene esnasında, topikal anestetik damla uygulamasını takiben, blefarosto göze yerleştirilmekte, kornea yüzeyine viskoelastik madde uygulanmakta ve kamera yüzeye tatbik edilerek görüntüler alınmaktadır.
RetCam’in potansiyel dezavantajları arasında, periferik retinayı görmede sınırlı olması ve hareket kısıtlamasının zor olduğu büyük çocuklardaki uyum sorunları sayılabilir. Klinik muayene ve RetCam görüntüleri karşılaştırarak yapılan ve ROP taramasında RetCam’in sensitivite ve sfesifitesinin değerlendirildiği bir çalışmada, sensitivite düşük olarak saptanmıştır. Zon 2 posteriorunda kalan tüm ROP’lar rahatlıkla görüntülenebilmekle birlikte, çalışmada atlanan ROP olguları, Zon 2’nin periferinde kalan Evre 1 ve 2 hastalıklardı.20 Ancak tüm atlanan olgularda spontan rezolüsyon görüldüğü belirtilmektedi. Yani RetCam ile tüm kritik durumların saptanabildiği görülmektedir.
RetCam, kullanım kolaylığı nedeniyle hemşireler ve sağlık görevlileri tarafından da rahatlıkla kullanılabilmekte ve görüntüler primer muayeneyi yapan doktora dijital ortamda yollanarak, takiplerin hasta ve doktor açısından rahat bir şekilde yapılabilmesi sağlanabilmektedir. Aynı zamanda legal olarak dökümentasyonun her geçen gün önemini arttırdığını da vurgulamakta fayda vardır.
7- PREFERENTIAL HİPERAKUİTE PERİMETRİ (PHP)
Yaşa bağlı makula dejenerasyonunun (YBMD) gelişmiş ülkelerde özellikle 65 yaş ve üzerinde ağır görme kayıpları ve yasal körlüklerin ana nedenlerinden olduğu bilinmektedir (22,23). YBMD tanısı alan hastaların yaklaşık olarak %90’ında ciddi görme kaybının esas nedeni koroid neovaskülarizasyonu (KNV) gelişimi olmaktadır (24). Günümüzde KNV olgularının bir kısmında fotodinamik tedavi ve intravitreal anti-anjiojenik ilaç uygulamaları ile oldukça tatminkar sonuçlar alınmaktadır. Ancak söz konusu tedaviler ile olguların çoğunda görme fonksiyonlarını iyileştirmekten ziyade görme kaybının önlenmesi sağlanmaktadır (25,26). Aynı zamanda tedavi anında daha küçük lezyon varlığının 2 senelik takiplerde daha iyi bir görme seviyesine neden olduğu bilinmektedir (26). Bu nedenle KNV’nun belirgin görme kaybı gelişmeden erken tanı ve tedavisi oldukça önem taşımaktadır. Risk altındaki hastalarda CNVM gelişimi açısında hastalar Amsler Grid ile takip edilmektedirler. Ancak Amsler Grid SMD hastalarında merkezi görme alanı defektlerinin saptanmasında fiksasyon, kortikal görüntü tamamlama ve crowding efekt gibi nedenlerden dolayı yeterli olamamaktadır.
PHP, YBMD’na bağlı KNV’nun saptanması ve progresyonunun incelenmesi için tasarlanmış otomatize bir görme alan testidir (27). PHP’nin yeni başlayan KNV tanısında % 82 oranında duyarlı ve % 88 oranında özgül olduğu bildirilmektedir (27). PHP esas olarak hiperacuity fonksiyonunu değerlendirmektedir. Vernier akuitesi olarak da bilinen hyperacuity, uzaysal lokalizasyonda iki veya daha fazla görsel stimulus arasındaki farkı dakika cinsinden ayırt etme yeteneğidir .Vernier akuitesi normal görme akuitesinden 10 kat daha hassastır ve bu nedenle beynin küçük görme alanı defektlerini kompanse etme yeteneğini altetmekte ve hastalar belirgin görme kaybı hissetmeden CNVM varlığını belirleyebilmektedir. PHP’deki görsel uyaranda olduğu gibi noktalardan oluşan bir çizgi sağlam retina tarafından algılandığında, vizüel korteks uyarılmakta ve sonuç olarak bu noktalardan oluşan düz bir çizgi görülmektedir. YBMD’na sekonder KNV’da olduğu gibi retina pigment epitel elevasyonu geliştiğinde, fotoreseptörlerin de yerleşimi değişmektedir. Farklı fotoreseptörler uyarılacağından vizüel kortekste temsil edilen fotoreseptör lokalizasyonları da değişecektir. Böylece düz noktasal sinyallerin olduğundan daha farklı veya kesik olarak algılandığı, bunun sonucunda metamorfopsi veya skotom geliştiği düşünülmektedir(28).
PHP ekranında beliren görsel uyaran, 1 CCFT (cold cathode fluorescent lamp) gücünde siyah zemin üzerinde aralıklarla beliren beyaz noktalardan oluşan çizgilerden oluşmaktadır. 27 adet beyaz noktadan oluşan çizgiler hem yatay hem de dikey olarak belirmektedir. Ekranda gözüken çizgilerde değişik yerleşimlerde ve değişik büyüklüklerde yapay distorsiyonlar mevcuttur. Bu yapay distorsiyonlar sayesinde hem kantitatif değerlendirme yapılmakta hem de güvenilirlik göstergeleri hesaplanmaktadır. Hastalardan çizgilerdeki distorsiyon bölgelerini özel bir işaretleme kalemiyle ekrana dokunarak işaretlemeleri istenmektedir (Resim 1).
RESİM 1. Preferential hyperacuity perimetre ekranında beliren görsel uyaran ve üzerindeki yapay distorsiyon izlenmekte.
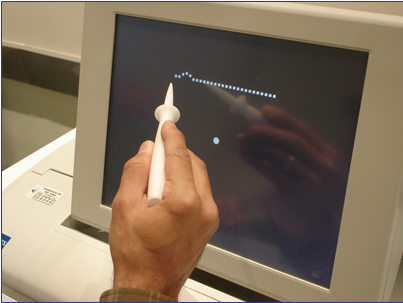
KNV mevcut olan hastanın vizüel korteksinde lezyon nedeniyle oluşan patolojik distorsiyon ve ekranda beliren yapay distorsiyon arasında bir karşılaştırma yapılmaktadır. Hasta daha belirgin olarak algıladığı büyük olan distorsiyon alanını seçecektir. Bu da tercihli bakış (preferential looking) olarak bilinmektedir. Sonuçta hasta hem yapay hem de patolojik distorsiyonu; sadece yapay distorsiyonu; sadece patolojik distorsiyonu işaretleyecek veya skotom alanına denk geldiği için hiç işaretleme yapmayacaktır. PHP tarafından hesaplanan sonuçlar normal sınırlarda veya normal sınırların dışında olmaktadır.
Tespit edilen herhangi bir distorsiyon veya skotom alanı otomatik olarak kaydedilerek hyperacuity deviasyon haritasındagösterilmektedir. Hyperacuity defekt haritasında ise KNV lezyonunun yerleşimi gösterilmektedir. Ayrıca yanlış pozitif ve yanlış negatif cevap oranlarından oluşan güvenilirlik göstergeleri hesaplanmaktadır.
PHP RPE’deki elevasyonları belirleyen noninvazif bir muayene yöntemidir. 3-5 dklık işlem sonrasında 14 derecelik maküler görme alanı işaretlenmektedir. Amsler grid, biomikroskopi ve fundus muayenesi ile yapılan rutin takip protokolünde KNV lezyonu 3,300 μm boyutuna ulaştığında ve genellikle subfoveal olduğunda saptanabilmektedir. Ancak PHP ile bu lezyonlar, ekstrafoveal ve yaklaşık 1,100μm boyutunda iken saptanabilmekte ve intravitreal enjeksiyon veya thermal lazer ile erken tedavi şansı olmaktadır.
- MAKUSKOP
Senil makula dejenerasyonu, günümüzde legal körlüklerin önemli bir bölümünü teşkil etmektedirler. Dünya genelinde 30 milyondan fazla insan bu hastalıktan etkilenmiş durumda olup, bu sayının 20-30 yıl içerisinde 2 katına çıkacağı düşünülmektedir. Semptomların ortaya çıkmasından önce, özellikle ailelerinde SMD hikayesi olan risk grubundaki bireylerin taranması, ana risk faktörlerinin erken dönemde saptanması ve gereken önlemlerin alınması, görme düzeyinin korunması açısından oldukça önemlidir.
Çeşitli çalışmalar SMD gelişimi açısından, düşük maküler koruyucu pigment dansitesinin( MPD) önemli bir risk faktörü olduğunu ortaya koymuştur29-31. Maküler pigment 3 karotenoidden oluşmaktadır:
- Lutein, zeaxanthine ve meso-zeaxantin.
Lutein ve zeaxanthine antioksidan maddeler olup, bu nedenle makulayı yaşlanma prosesinden korumaktadırlar. Lutein ıspanak ve diğer yeşil sebzelerde, zeaxantin ise mısırda bulunmaktadır. Meso-zeaxantin makulanın santralinde bulunur ve diet ile alınan bir madde değildir. Luteinin makulada meso-zeaxantine dönüşmesi ile ortaya çıkar ve diğer iki komponentten çok daha iyi bir koruyucudur. Maküler pigmentin %25’ini oluşturur. İrlanda’da Maküler Pigment Araştırma Merkezinde yapılan çalışmaya göre meso-zeaxantin’in alınmaya başlanması ile 140 gün içerisinde %40 oranında retinada repigmentasyon ortaya çıkmıştır. Makuskop MPD’yi ölçen ilk aygıttır. Non-invazif, ağrısız, dilatasyon gerektirmeyen ve tek gözün muayenesinin yeterli olduğu bir yöntemdir. İşlem toplam 2-3 dk sürmektedir.
Makuskop bir heterokromik fliker fotometredir. Değişen şekillerde mavi ve yeşil ışık çakmaları kullanılarak koruyucu MPD ölçümü esasına dayanır. Mavi ışık maküler pigment tarafından emilirken yeşil ışık emilmez. Hasta başını alete koyar ve küçük yanıp sönen mavi/yeşil bir ışığa bakması ve yanıp sönen ışık yavaşladığı ve durduğu zaman testi yapana söylemesi istenir. Daha yoğun makuler pigmente sahip olan kişilerde yanıp sönmenin durması için daha fazla mavi ışık miktarı gerekli olacaktır.
Test sonucunda pigment düzeyi düşük, ortalama veya yüksek olarak sınıflandırılmakta ve hastalar 0 1 arasındaki risk gruplarına dahil edilmektedir. Ortalama değer 0.42 olup bu zamanla düşüş göstermektedir.
MPD değerinin, 30 yaştan itibaren giderek azaldığı ve maküler dejenerasyona gidiş olan kişilerde bu değerin normal bireylere göre daha düşük olduğu gösterilmiştir. Bu bilgiye dayanarak 30 yaş ve üzeri hastaların, özellikle ailelerinde SMD öyküsü varsa macuscope ile taranması yararlı olabileceği belirtilmektedir. Firma tarafından, aile hikayesi ve diğer yüksek risk faktörleri olan olgular lutein, zeaxanthine ve meso-zeaxantin içeren preperatlar başlanarak 6 aylık dönemlerde kontrol edilebilir dense de, alet üzerine yapılan bilimsel çalışmaların olmaması nedeniyle yaygın bir kullanım bulamamıştır. Bu alanda ileri çalışmalar yapılması gereklidir.
- QuantiEye
Macuscope ile benzer şekilde çalışmakta ve yine benzer olarak MPD’yi ölçmektedir. Ancak bu aletle de yapılmış çalışmalar henüz mevcut değildir.
Hem Macuscope hem de QuentiEye’daki amaç
- SMD için risk gruplarını belirlemek
- Erken destekleyici tedaviye başlamak
- Maküler dejenerasyonun başlamasını engellemektir.
KAYNAKLAR
1- Von Ruckmann A, Fitzke FW, Fan J, Halfyard A, Bird AC. Abnormalities of fundus autofluorescence in central serous retinopathy. Am J Ophthalmol 2002 Jun; 133(6):780-6.
2- Holz FG, Bellman C, Staudt S, Schutt F, Völcker HE. Fundus autofluorescence and development of geographic atrophy in age-related macular degeneration. Invest Ophthalmol Vis Sci 2001 Apr; 42(5):1051-6.
3- Carsten Framme, Johann Roider, Helmut G Sachs, Ralf Brinkmann,Veit-Peter Gabel. Noninvasive Imaging and Monitoring of Retinal Pigment Epithelium Patterns Using Fundus Autofluorescence. Review Current Medical Imaging Reviews, 2005, 1, 89-103.
4- Ruth Axer-Siegel, Dan Bourla, Ethan Priel, Yuval Yassur, Dov Weinberger. Angiographic and Flow Patterns of Retinal Choroidal Anastomoses in age-related macular degeneration with Occult Choroidal Neovascularization. Ophthalmology 2002 Sept; 109 (9):1726-36.
5- Huang D, Swanson EA, Lin CP, et al. Optical coherence tomography. Science, 1991;254:1178–81.
6- Swanson EA, Izatt JA, Hee MR, et al. In-vivo retinal imaging by optical coherence tomography. Opt Lett 1993;18:1864–6.
7- Thomas D, Duguid G. Optical coherence tomography—a review of the principles and contemporary uses in retinal investigation. Eye 2004;18:561–70.
8- Wojtkowski M, Leitgeb R, Kowalczyk A, et al. In vivo human retina imaging by Fourier domain optical coherence tomography. J Biomed Opt 2002;7:457– 63.
9- Nassif N, Cense B, Park B, et al. In vivo high-resolution video-rate spectral-domain optical coherence tomography of the human retina and optic nerve. Opt Express 2004;12:
10- Wojtkowski M, Leitgeb R, Kowalczyk A, et al. In vivo human retinal imaging by Fourier domain optical coherence tomography. J Biomed Opt. 2002; 7:457-463.
11- Leitbeg RA, Drexler W, Unterhuber A, et al. Ultrahigh resolution of Fourier domain optical coherence tomography. Opt Express 2004; 13:583-594.
12- Bower BA, Zhao M, Chu A, et al. Rapid volumetric imaging of the human retina invivo using a low cost, spectral domain optical coherence tomography system. Invest Ophthalmol Vis Sci. 2005; 46:1050.
13- Mundt G H, Hughes W F. Ultrasonics in ocular diagnosis. Am. J. Ophthalmol. (1956);42: pp. 488–498.
14- Baum G, Greenwood I. The application of ultrasonic locating techniques to ophthalmology-part 2. Ultrasonic visualization of soft tissues. Arch. Ophthalmol. (1958);60: pp. 263–279.
15- Coleman D J, Silverman R H, Chabi A et al. High resolution ultrasonic imaging of the posterior segment. Ophthalmology (2004);111: pp. 1,344–1,351.
16- Harasymowycz P J, Affel E L, Spaeth G L et al. Comparison of the 20-MHz ultrasound probe with ultrasound biomicroscopy in glaucoma. Ophthalmic Surg. Lasers Imaging (2004);35: pp. 347–349.
17- Hewick SA, Fairhead AC, Culy JC, Atta HR. A comparison of 10 MHz and 20 MHz ultrasound probes in imaging the eye and orbit. Br J Ophthalmol. 2004 Apr;88(4):551-5.
18- Vingolo EM, Cavarretta S, Domanico D, Parisi F, Malagola R. Microperimetric biofeedback in AMD patients. Appl Psychophysiol Biofeedback. 2007 Dec;32(3-4):185-9. Epub 2007 Jun 16.
19- Vujosevic S, Midena E, Pilotto E, Radin PP, Chiesa L, Cavarzeran F. Diabetic macular edema: correlation between microperimetry and optical coherence tomography findings. Invest Ophthalmol Vis Sci. 2006 Jul;47(7):3044-51.
20- Roth DB, Morales D, Feuer WJ, Hess D, Johnson RA, Flynn JT. Screening for retinopathy of prematurity employing the Retcam 120: sensitivity and specificity. Arch Ophthalmol 2001;119:268–272.
21-Seiberth V, Woldt C. Wide angle fundus documentation in retinopathy of prematurity. Ophthalmologe 2001;98:960–963.
- Age-Related Eye Disease Study Research Group. The Age-Related Eye Disease Study (AREDS): Design implications. AREDS report no. 1. Control Clin Trials 1999; 20(6):573-600.
- Erdem Ü, Bayraktar MZ, Uysal Y. Yaşa bağlı makula dejenerasyonunda antioksidan tedavinin etkinliği-1. Retina-Vitreus 2004;12:26-29.
- Ferris FL III, Fine SL, Hyman L. Age-related macular degeneration and blindness due to neovascular maculopathy. Arch Ophthalmol 1984;102:1640-1642.
- Treatment of Age-Related Macular Degeneration with Photodynamic Therapy (TAP) Study Group. Photodynamic therapy of subfoveal choroidal neovascularization in age-related macular degeneration with verteporfin: two years results of 2 randomized clinical trials-TAP report 2. Arch Ophthalmol 2001;119:198-207.
- Treatment of Age-Related Macular Degeneration wit Photodynamic Therapy Study Group, Verteporfin in Photodynamic Therapy Study Group. Effect of lesion size, visual acuity, and lesion composition on visual acuity change with and without verteporfin therapy for choroidal neovascularization secondary to age-related macular degeneration: TAP and VIP report no. 1. Am J Ophthalmol 2003;136:407-418.
- Preferential Hyperacuity Perimetry Study Group. Preferential hyperacuity perimeter (Preview PHP) for detecting choroidal neovascularization study. Ophthalmology 2005;112:1758-1765.
28-Preferential Hyperacuity Perimeter (PHP) Research Group. Results of a multi-center clinical trial to evaluate the preferential hyperacuity perimeter for detection of age-related macular degeneration. Retina 2005;25:296-303.
29- Beatty S, Murray IJ, Henson DB, et al. Macular pigment and risk for age-related macular degeneration in subjects from a Northern European population. Invest Ophthalmol Vis Sci. 2001 Feb;42(2):439-46.
30- Bone RA, Landrum JT, Mayne ST, et al. Macular pigment in donor eyes with and without AMD: a case-controlled study. Invest Ophthalmol Vis Sci. 2001 Jan;42(1): 235-40.
31- Delacourt C, Carriere I, Delage M, et al. Plasma lutein and zeaxanthin and other carotenoids as modifiable risk factors for age-related maculopathy and cataract: the POLA Study. Invest Ophthalmol Vis Sci. 2006 Jun;47(6):2329-35.

